Des bactéries à l'homme, le tripeptide (gamma-glutamyl-cystéine-glycine)
appelé "glutathion" joue un rôle majeur, mais pas toujours bien connu
au niveau moléculaire, dans les processus cellulaires de détoxication des
espèces oxydantes (peroxydes), des "déchets" métaboliques (tels le
méthylglyoxal), des xénobiotiques (antibiotiques, etc) et des métaux lourds.
Par une approche de génétique et de métabolomique, l’équipe LBBC du SB2SM,
en collaboration avec le SPI/LEMM, a étudié les enzymes de la biosynthèse (GshA
et GshB) et du catabolisme (Ggt) du glutathion (GSH), chez la cyanobactérie
modèle Synechocystis PCC6803. Il a
été montré que:
i) Les
trois gènes gshA, gshB et ggt sont indispensables à la croissance photoautotrophique de Synechocystis. Ceci est en accord avec
la théorie consensuelle selon laquelle les cyanobactéries auraient
"inventé" le GSH pour se protéger du stress oxydant créé par leur
puissante activité photosynthétique (elles ont vraisemblablement produit
l'oxygène de notre atmosphère).
ii) Les
enzymes GshA et GshB interviennent aussi dans la synthèse de l'ergothionéine
(EGT), un autre métabolite anti-oxydant mal connu, produit par certains
microorganismes vivant dans les sols. "L'indispensabilité" de gshA et gshB résulterait du fait qu'ils fabriquent à la fois le GSH et
l'EGT. Plus stable que le GSH, l'EGT passe la barrière digestive, ce qui permet
à l'homme de l’absorber en consommant des plantes, qui ont capté l'EGT par
leurs racines, et des animaux qui ont ingéré des cyanobactéries (coquillages,
poissons) ou des plantes (bovins et ovins). Comme le GSH, l'EGT utilise un
atome de soufre pour effectuer ses réactions "rédox", mais la
sélectivité/redondance des fonctions du GSH et de l'EGT sont très mal connues.
iii) En
plus du GSH et de l'EGT, les enzymes GshA et GshB interviennent également dans
la synthèse de l'ophthalmate (gamma-glutamyl-2-amino-butyryl-glycine) et du
norophthalmate (gamma-glutamyl-alanyl-glycine), deux analogues du GSH dépourvus
de cystéine (et donc de soufre). L'ophthalmate (OPH) et le norophthalmate
(NOPH) ont été initialement découverts dans l'œil des mammifères; leur présence
chez les cyanobactéries rappelle que le métabolisme central des cellules a été
bien conservé par l'évolution. Chez l'homme, l'OPH s'accumule dans le foie en
réponse aux stress (déséquilibres alimentaires, médicaments), et on ne sait
rien du rôle du NOPH. En outre, les cellules diabétiques et vieillissantes
accumulent des métabolites toxiques (ex : méthylglyoxal) qui engendrent
des pontages (glycations) inter-protéines. Le méthylglyoxal est détoxifié par
les glyoxalases, des enzymes dépendantes du GSH, comme nous le montrons ici chez
des cyanobactéries après un stress au glucose. L’ensemble de ces résultats
suggère qu'en réponse aux stress les cellules augmentent leur utilisation et
leur synthèse de glutathion, parfois jusqu'à manquer de cystéine; elles
produisent alors de l'ophthalmate et du norophthalmate qui signalent la
déplétion en cystéine.
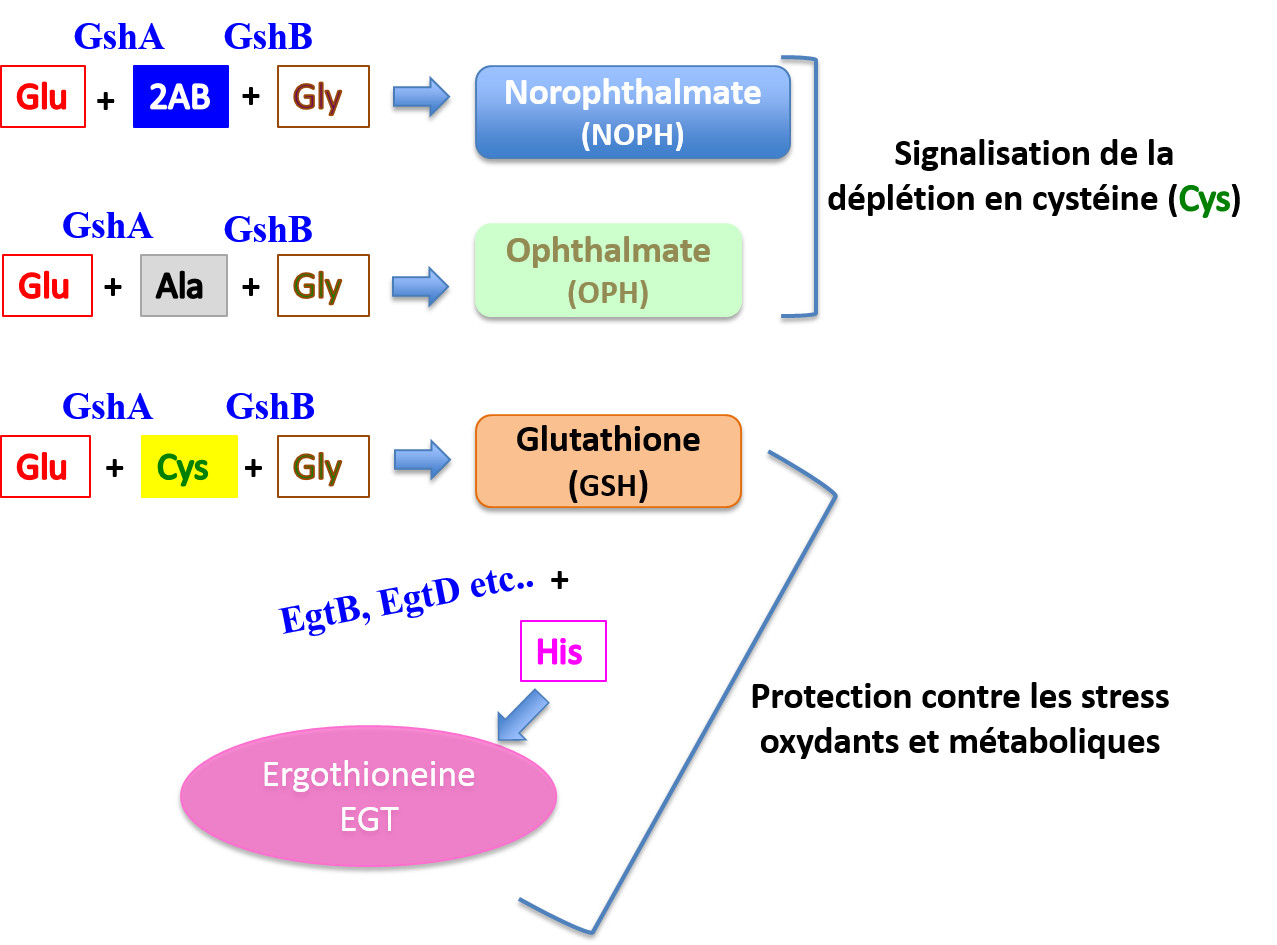
Schéma récapitulatif du rôle du glutathion et de ses analogues dans les réponses aux stress oxydant et métabolique.
GshA = glutamate-cystéine ligase; GshB = glutathione synthase;
Glu = glutamate; 2AB = 2 aminobutyrate; Gly = glycine; Ala = alanine; Cys = cystéine; His = histidine; EgtB, EgtD = enzymes impliquées dans la synthèse de l'ergothionéine
Cette nouvelle étude montre que la cyanobactérie Synechocystis, dotée d'une morphologie simple (unicellulaire) et
d'un petit génome (4 Mb) facilement manipulable, est parfaitement adaptée à
l'analyse moléculaire de la sélectivité/redondance des fonctions cellulaires et
moléculaires de l'ergothionéine, du glutathion et de ses homologues ophthalmate
et norophthalmate, qui ont été conservés par l'évolution. Les cellules humaines
synthétisent le glutathion, l'ophthalmate et le norophthalmate, et acquièrent
l'ergothionéine via l’alimentation.
L'intérêt de Synechocystis pour ces
études est renforcé par le fait que les divers microorganismes modèles très
connus tels la bactérie Escherichia coli
et la levure (eucaryote) Saccharomyces
cerevisiae, ne semblent pas capables de produire l'ergothionéine.