- Les télomères sont les complexes nucléoprotéiques qui protègent les extrémités des chromosomes linéaires eucaryotes contre la dégradation ou la réparation illicite. A chaque division cellulaire, les télomères raccourcissent du fait de leur réplication incomplète jusqu'à une longueur critique à laquelle les cellules entrent en sénescence. L'intégrité des télomères est essentielle pour maintenir la stabilité du génome, et leur dysfonctionnement est associé à des cancers et des pathologies du vieillissement. Chez toutes les espèces eucaryotes, les télomères sont constitués de répétitions en tandem d'une courte séquence d'ADN auxquelles se lient des protéines spécifiques, ce qui induit la formation de compartiments subnucléaires fortement enrichis en protéines télomériques. Dans la régulation de nombreux processus cellulaires, les interactions transitoires et/ou de faible affinité (KD > 10-4 M) sont aussi importantes que celles de haute affinité (KD < 10-6 M). Or, les fonctions associées à l'état de télomère long ou à l'état de télomère court sont différentes. Par conséquent, les variations de concentrations locales consécutives au raccourcissement des télomères peuvent être reliées à des switch fonctionnels cruciaux. La compréhension des interactions transitoires associées aux assemblages télomériques prend donc un sens particulièrement important. Cependant, les limites méthodologiques pour étudier ce type d'interactions affectent notre compréhension des processus de régulation dans lesquels elles sont impliquées.
- TRF2 et RAP1 sont les protéines télomériques les plus abondantes chez les mammifères et sont essentielles pour établir un télomère fonctionnel. TRF2 est centrale au télomère : elle interagit directement avec l'ADN double-brin qu'elle est capable de condenser, elle recrute la protéine RAP1, et est capable d'interagir avec un grand nombre de protéines. RAP1 est une des protéines télomériques les plus conservées, bien que ses propriétés fonctionnelles restent mal comprises. Une de nos études récentes a mis en évidence que lorsque TRF2 n'est plus capable de protéger les extrémités télomériques contre certaines voies de réparation de l'ADN, RAP1 serait l'ultime sauvegarde de cette fonction.
Dans la présente étude, il a été observé que RAP1 affecte les propriétés d'interaction de TRF2 avec l'ADN, et l'effet de RAP1 sur la conformation de TRF2 a été suivi par une approche de biologie structurale intégrative. L'étude par SAXS de TRF2 et RAP1 et de leur complexe a révélé que les deux protéines sont très flexibles, et qu'elles subissent un ajustement conformationnel majeur lors de la formation du complexe. La combinaison de cristallographie, d'ITC et d'empreinte protéique a permis de compléter l'analyse par SAXS et de décrire de façon complète et à l'échelle moléculaire l'assemblage entre ces deux protéines.
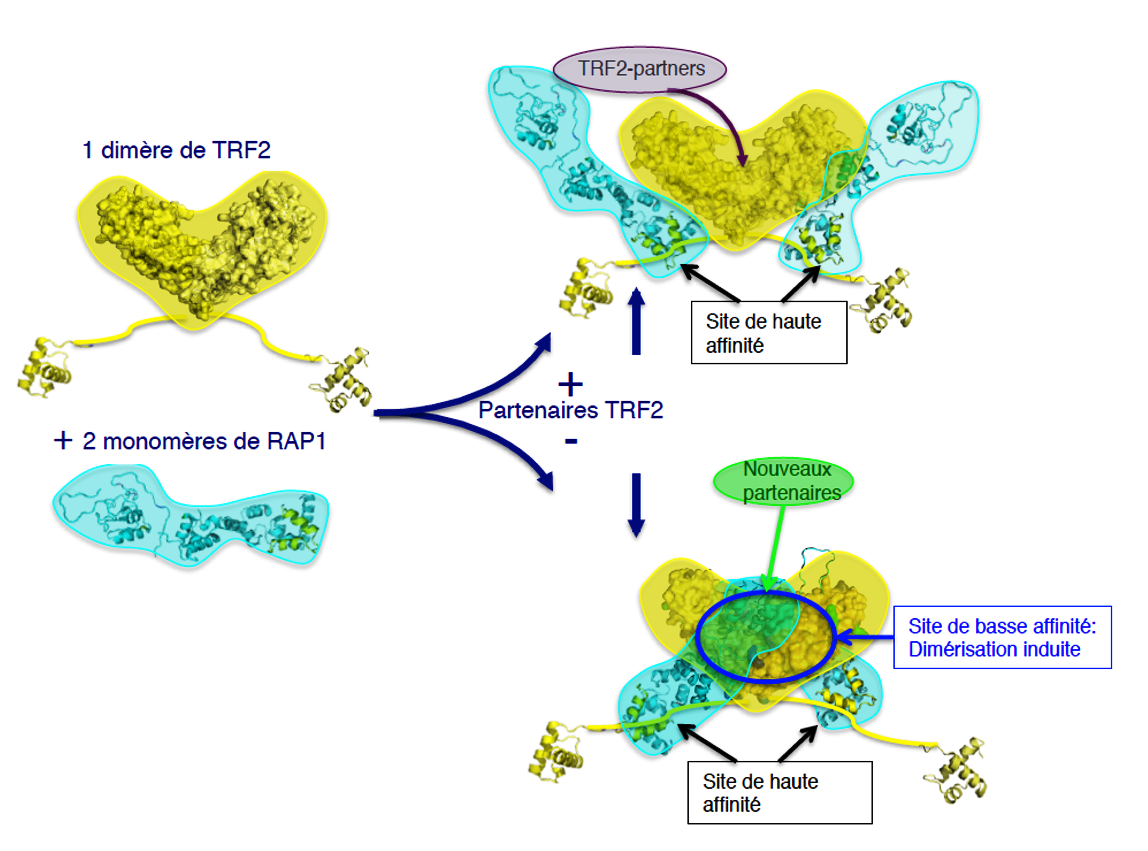
Figure : Représentation schématique des différents états conformationnels de TRF2 et RAP1 seules (à gauche), ou en interaction partielle autorisant l'interaction de partenaires spécifiques de TRF2 (en haut à droite) ou en interaction complète induisant de nouvelles surfaces d'interactions avec de nouveaux partenaires.
Ces données montrent que le mode d'interaction entre RAP1 et TRF2 met en jeu un gradient d'affinité compatible avec la formation d'assemblages différents selon la concentration locale, ou la présence de partenaires de haute affinité dans le milieu environnant (voir figure). Cette capacité d'ajustement est en accord avec une plasticité fonctionnelle dépendante des concentrations locales. Ainsi, la flexibilité de TRF2 et RAP1 est une propriété essentielle leur permettant de former des entités structurales spécifiques avec leurs partenaires fonctionnels adaptées aux différents états du télomère.
* Guillaume Gaullier, ancien thésard de Marie-Hélène
Le Du (SB2SM/LBSR), et premier signataire du
présent article, s’est vu remettre le prix de thèse 2016 de
l’Association Française de Cristallographie
(mention Biologie) pour son travail : « Étude
structurale de l’assemblage du complexe télomérique
humain TRF2/RAP1. »
La remise des prix aura lieu le 04 juillet prochain, à l’occasion du congrès 2016 de l’AFC.