La cristallogenèse est le thème principal de la recherche effectuée. Le but est de développer de nouvelles approches pour la cristallisation des protéines et d'améliorer constamment les techniques courantes.
Responsable
Enrico STURA
enrico.stura@cea.fr
Le kit de cristallogenèse CryoProtX
Pour une meilleure qualité de diffraction
Récemment, le laboratoire a développé un kit de cristallogenèse afin de conserver un bon état cristallin des protéines. Il s’agit du kit CryoProtX.
© CryoProtXTM
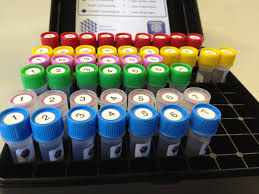 "La cryoprotection est l’étape critique précédant la congélation des cristaux qui peuvent être aussi bien améliorés qu’endommagés. Une bonne solution cryoprotectrice doit stabiliser l’état cristallin et favoriser la vitrification de l’eau pour éviter la formation de glace lors de la congélation à l’azote liquide. Sa composition peut être différente de la solution de cristallisation étant donné que la solution cryoprotectrice n’a pas besoin d’induire de nucléation, d’établir un équilibre entre la protéine cristallisée et le précipitant ni même de permettre une croissance cristalline. Le choix de la solution cryoprotectrice optimale se fait sur
"La cryoprotection est l’étape critique précédant la congélation des cristaux qui peuvent être aussi bien améliorés qu’endommagés. Une bonne solution cryoprotectrice doit stabiliser l’état cristallin et favoriser la vitrification de l’eau pour éviter la formation de glace lors de la congélation à l’azote liquide. Sa composition peut être différente de la solution de cristallisation étant donné que la solution cryoprotectrice n’a pas besoin d’induire de nucléation, d’établir un équilibre entre la protéine cristallisée et le précipitant ni même de permettre une croissance cristalline. Le choix de la solution cryoprotectrice optimale se fait sur
plusieurs cycles de collecte de données de sorte qu'il devient possible de faire évoluer les solutions pour obtenir de meilleurs résultats à chaque fois avec une large gamme de cristaux. Parfois des manipulations de post-cristallisation telles que la déshydratation et le “recuit” peuvent augmenter la qualité des données qui peuvent être collectées, cependant, l'utilisation d'une bonne solution cryoprotectrice permet de préserver l'ordre cristallin.
Trouver une solution cryoprotectrice qui « marche » n'est pas aussi difficile que d’en trouver une qui
« marche vraiment ». Une stratégie de cryoprotection bien pensée exige une composition optimale des composants afin que les cristaux soient stables pendant de longs trempages. L'approche que nous utilisons consiste en une formulation de plusieurs composés qui permettent de donner un « équilibre » à la solution qui ne sera donc ni solubilisante, ni précipitante. Pour une préparation rapide de la collecte des données synchrotron, les combinaisons sont pré-mélangées. Ainsi, on choisit un pré-mélange auquel on ajoute un précipitant et un tampon de son choix afin d’obtenir une solution prête à l’emploi en moins d’une minute. Cette stratégie diffère de la pratique générale qui consiste à utiliser un seul produit chimique antigivrage, souvent le glycérol, une molécule capable d'améliorer la solubilité des protéines. Les mélanges sont sélectionnés à travers un processus évolutif résultant en des solutions qui n’augmentent ni ne diminuent la solubilité des protéines mais assurent une stabilisation prolongée pendant la cryoprotection permettant de longues périodes de trempage sans que les cristaux ne se fissurent ni ne se dissolvent.
Afin de communiquer et partager cette nouvelle approche de la cryoprotection, un accord a été établi entre Molecular Dimensions et le CEA. Ainsi, Molecular Dimensions détient le monopole de la fabrication et de la vente de ce kit et, n'ayant aucun intérêt financier en tant qu'auteurs, nous continuons d'entretenir nos relations amicales et d'être fournis gratuitement en kits développés par nos soins : Stura Footprint Screens et maintenant CryoProtX."
Cristallogenèse
©CEA/E. Stura
Les nouveaux développements incluent l'utilisation des anticorps et l'ingénierie de protéines bactériennes qui lient les immunoglobulines pour favoriser la cristallisation des complexes antigène-anticorps, ainsi que, la construction de systèmes protéiques d'échafaudage en employant des protéines de fusion et des étiquettes peptidiques afin d'éviter de produire de nouveaux anticorps contre chaque nouvelle cible protéique.
©CEA/E. Stura
Les complexes entre protéines, entre protéines et acides nucléiques ou entre protéines et peptides sont biologiquement plus intéressants que la protéine seule. Les complexes peuvent présenter des difficultés additionnelles pour la cristallisation, mais dans le cas des macromolécules difficiles à cristalliser seules ils apportent aussi de nouvelles opportunités sur tout quand le système devient combinatoire avec plusieurs partenaires. Quand deux anticorps ont des épitopes distincts, ils peuvent être utilisés dans un complexe sandwich.
©CEA/E. Stura
L'amélioration des méthodes courantes inclut la mise au point de techniques de criblage pour une recherche plus efficace des conditions de cristallisation quand on ne dispose que de faibles quantités de protéine, et une utilisation plus ciblée des additifs qui peuvent améliorer la taille et la qualité des cristaux obtenus. Ceci inclut les additifs qui contrôlent l'oxydation ou la réduction des cystéines libres, et ceux qui modifient les caractéristiques de nucléation et de croissance cristalline. L'expertise en cristallogenèse est mise à la disposition des collaborateurs qui ont des besoins structuraux afin d'assurer la bonne réussite des projets en cours.
Ingénierie des protéines et Immunologie
Fragment Fc des IgG
Dans le domaine des anticorps nous partageons avec le Dr. Sylvie Jorieux de l'Unité de Recherche du LFB un intérêt particulier pour la partie Fc des immunoglobulines G humaines et pour son mode de fixation sur ses récepteurs; ce fragment est la cible d'une réponse pathologique de la part du système immunitaire, notamment les facteurs rhumatoïdes.
©CEA/E. Stura
Le fragment Fc est utilisé comme partenaire de fusion pour l'expression des glycoprotéines. Nous avons effectué des essais pour obtenir des cristaux de glycoprotéines fusionnées à des Fc complexés au facteur rhumatoïde.
Antigènes et Epitopes des Anticorps
Le deuxième domaine de spécialisation concerne les interactions protéine-protéine, et plus spécifiquement les interactions entre anticorps et antigènes, l'antigène pouvant être un marqueur du cancer, un stéroïde, un peptide ou une protéine dérivée de microbe pathogène ou de virus. Cette thématique est partagée avec l'Unité Mixte BioMérieux-CEA qui est sous la responsabilité du Dr. Frédéric Ducancel.
Toxicologie nucléaire environnementale
Dans le cadre d'une collaboration avec Eric Quemeneur, nous avons résolu la structure cristalline de deux anticorps ayant comme hapten l'uranyle phenanthroline.
Toxines
Dans le cadre d'une collaboration avec Denis Servent, nous avons résolu la structure cristalline de la toxine muscarinique MT7 utilisée pour construire le modèle sur le récepteur hM1.
L'équipe est aussi intéressée par le toxines bactériennes responsables de modifications des petites protéine G comme l'Exoenzyme C3 de Clostridium botulinum responsable de l'ADP-ribosylation de RhoA et des grande toxines clostridiales qui ciblent la même protéine humaine.