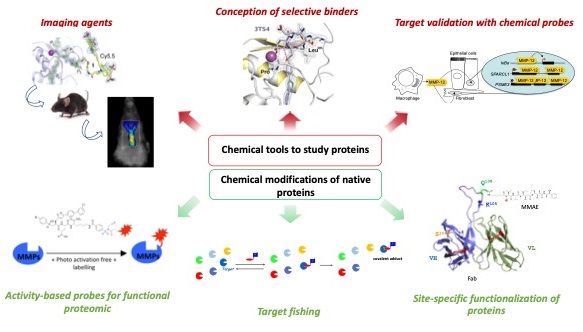
Notre équipe possède une longue expérience dans la conception d'outils chimiques pour étudier les enzymes et les protéines dans des systèmes de complexité variable, y compris des cibles isolées, des milieux de culture et des lysats cellulaires ainsi que des animaux vivants. Nous avons contribué à l'identification de plusieurs inhibiteurs hautement sélectifs des métalloprotéases matricielles (MMPs). (Conception d'un inhibiteur sélectif : Rouanet-Mehouas et al J. Med. Chem. 2017, Czarny et al., J. Med. Chem. 2013, Devel et al., J. Biol. Chem 2012, Devel et al., J. Biol. Chem 2010, Devel et al., J. Biol. Chem 2006).
Dans les modèles précliniques, les composés les plus sélectifs ont notamment permis de décrypter le rôle essentiel de ces protéases dans l'athérosclérose, la progression du cancer et au cours d'une infection virale (Validation de cibles à l'aide de sondes chimiques : Ella et al., J. Thorac. Cardiovasc. Surg. 2018, Marchant et al, Nat. Med. 2014, Meides et al., Int J Cancer. 2014, Johnson et al., Arterioscler. Thromb. Vasc. Biol. 2011). En s'appuyant sur la validation de cet inhibiteur chez l'animal, notre équipe a aussi récemment conçu des agents d'imagerie originaux pour détecter spécifiquement l'élastase des macrophages (MMP12) dans des modèles précliniques d'anévrisme et d'athérosclérose (Agents d'imagerie : Gona et al., J. Med. Chem 2020, Toczek et al.; J. Med. Chem 2019, Devel et al., Molecules. 2019, Razavian et al., Sci. Report 2016, Bordenave et al, Bioconjugate 2016). Dans le but de documenter l'état d'activation des MMPs dans différents processus biologiques, nous avons développé plusieurs séries de sondes chimiques réactives capables de modifier de manière covalente ces enzymes dans des protéomes complexes et in vivo (Sondes basées sur l'activité pour la protéomique fonctionnelle : Kaminska et al., Angewandte Chem. Int. Ed. 2021, Torkar et al., Bioorg. Med. Chem. Lett 2013, Torkar et al., ChemBioChem 2012, Bregant et al., J. Proteomic Res. 2009, David et al., Angewandte Chem. Int. Ed. 2007).
Dans la même veine, nous développons actuellement des approches protéomiques ciblées qui combinent la chimie dirigée par les ligands et les stratégies de dérivatisation avec un marqueur de masse. (Sejalon-Cipolla et al., Trends in Analytical Chemistry 2021). Ces approches sont également utilisées dans des projets de "target fishing" pour déterminer les cibles protéiques privilégiées de composés biologiquement actifs.
En parallèle, nous explorons de nouvelles approches permettant la fonctionnalisation spécifique des protéines. Dans ce domaine, nos récentes réalisations ont trouvé des applications dans le double marquage radioactif de conjugués anticorps-médicament (ADCs), dont le devenir in vivo de la charge utile cytotoxique et du vecteur protéique peut être déterminé de manière sensible et précise par imagerie numérique ex vivo. Notre approche complète l'ensemble très restreint de méthodes bioanalytiques disponibles pour la détection et la quantification des ADCs dans diverses matrices biologiques (Cahuzac et al., Pharmaceuticals 2020).