Mettre au point de nouveaux vaccins
Les salmonelles et shigelles sont responsables de maladies gastro-intestinales partout dans le monde et sont régulièrement responsables de flambées épidémiques, particulièrement en Asie du Sud-Est et en Afrique. Ces flambées sont d'autant plus problématiques que des multirésistances aux antibiotiques sont apparues. Les vaccins développés ne sont pas commercialisés ou ne couvrent qu'un nombre limité de sérotypes (sous-espèces). Il existe donc un besoin crucial de développer de nouveaux vaccins prophylactiques ou thérapeutiques à large spectre, agissant contre les deux genres bactériens. Dans cette optique, des chercheurs du LERI (SPI/DMTS) s’intéressent au système de sécrétion de type 3 qui permet à Salmonella et Shigella d’injecter leurs facteurs de virulence au travers de la membrane plasmique des cellules de l’hôte. Les protéines SipD et IpaD, appartenant respectivement à la pointe du système de sécrétion de Salmonella et Shigella, sont de bons candidats pour ce type de thérapie. Dans une étude précédente (Cf. actualité du 22 juin 2020), les chercheurs du LERI ont montré l’induction d’une protection croisée contre une infection à salmonelle et shigelle en utilisant SipD ou IpaD comme immunogène.
Un anticorps monoclonal ciblant 2 protéines
Ces résultats encourageants ont conduit les chercheurs à aller plus loin : ils ont réussi à développer un anticorps monoclonal (Acm) dirigé contre une région commune conservée des deux protéines, malgré une identité de séquence protéique de l’ordre de 40%. Leurs travaux, en collaboration avec une équipe du SIMoS et publiés dans PLoS Neglected Tropical Diseases, montrent que l’anticorps protège relativement efficacement en prophylaxie contre des infections à salmonelles et shigelles dans un modèle murin. Les auteurs ont déterminé précisément l’épitope de reconnaissance de cet Acm, situé dans la partie apicale des protéines SipD et IpaD. In vitro, ils ont montré que l’Acm a une faible capacité à inhiber la formation des pores dans la membrane des cellules hôtes, voire au contraire qu’il la favorise. En revanche, il bloque au moins partiellement l’invasion bactérienne. Ces observations confirment que formation des pores et invasion bactérienne, déjà identifiées comme portées par deux domaines distincts d'IpaD, sont mécanistiquement dissociées.
Étant donné que la région ciblée par cet Acm est essentielle à la virulence de l'agent pathogène et qu'elle est conservée parmi les bactéries Salmonella et Shigella, il serait intéressant d'envisager le développement et l'évaluation de composés chimiques ou de vaccins ciblant cette région spécifique pour une activité à large spectre. Compte tenu des progrès récents dans le domaine de l'ingénierie des anticorps monoclonaux recombinants et des études réalisées sur leur administration orale, en particulier contre les infections à Salmonella, la lutte contre les maladies diarrhéiques induites par Salmonella et Shigella par l'administration d'Acm seuls ou en combinaison avec d'autres molécules pourrait devenir réaliste et rentable.
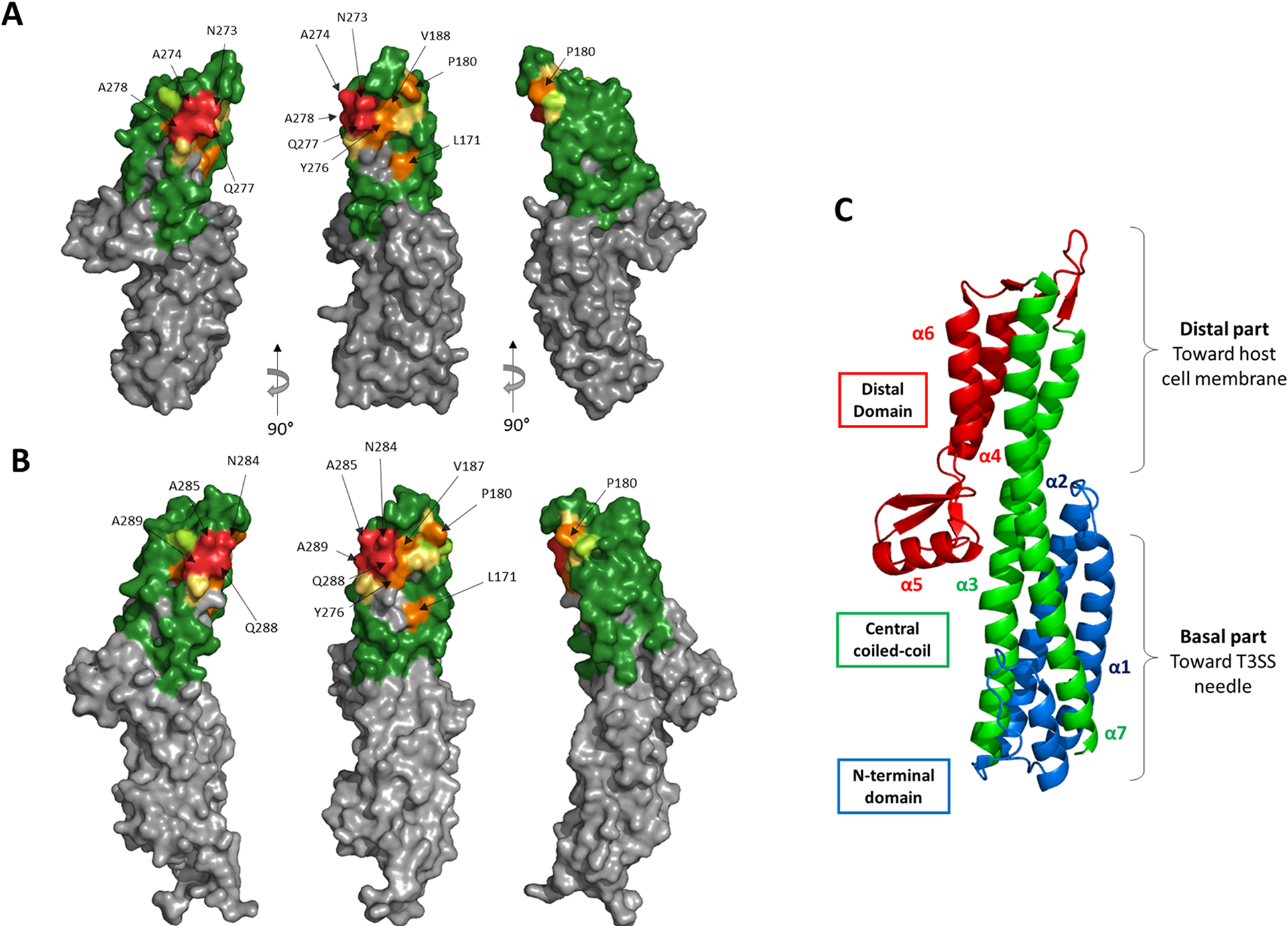
Représentation structurale de l'épitope de l'anticorps monoclonal IpaD-318 sur l'antigène IpaD tel que déterminé par "yeast display".
(A) Les résidus ont été colorés sur la structure de IpaD (PDB #2J0O) en fonction de l'importance de chaque résidu testé dans l'interaction. Les résidus en gris n'ont pas été testés. (B) Représentation de l'épitope de l'AcM IpaD-318 sur l'antigène SipD (PDB #3NZZ). (C) Description structurelle de IpaD. © Sierocki et al., PLoS Negl. Trop. Dis., 2021
Contact Joliot :
Stéphanie Simon (stephanie.simon@cea.fr)