C'EST QUOI UN CENTRE FER-SOUFRE ?
Les centres Fer-Soufre (Fe-S) sont des assemblages de fer et de sulfure constitutifs des sites actifs d'un très grand nombre de protéines intervenant dans une multitude de processus biologiques essentiels tels que la production d'ATP, la catalyse enzymatique, la synthèse protéique ou encore la maintenance de l'intégrité du génome. Ils sont synthétisés par des machineries multi-protéiques et sont ensuite insérés dans les protéines cibles, selon un processus complexe, en plusieurs étapes. La déficience de l'une des protéines de cette machinerie peut conduire à des pathologies sévères, dont la plus fréquente chez l'Homme est l'ataxie de Friedreich, une maladie rare, neurodégénérative et cardiaque, causée par un déficit génétique en frataxine. Les stratégies thérapeutiques basées sur le développement de composés mimant la fonction de la frataxine sont encore limitées par le manque de connaissance des mécanismes régissant la biogenèse de ces cofacteurs. Par ailleurs, la thérapie génique se heurte à la toxicité d'une surexpression en frataxine.
Depuis plusieurs années, l'équipe de Benoit D'Autréaux travaille à élucider le mécanisme de biosynthèse de ces clusters en reconstituant in vitro la machinerie d'assemblage (iron-sulfur cluster, ISC) des centres Fe-S. Après avoir démontré en 2022 que la biosynthèse d'un cluster Fe-S était un processus hautement conservé, initié par l'insertion de fer au site d'assemblage de la protéine d'échafaudage IscU (iron-sulfur cluster assembly enzyme) (voir actu Joliot), les auteurs ont publié en 2025 deux articles majeurs.
ASSEMBLAGE ÉTAPE PAR ÉTAPE DES CLUSTERS [2FE–2S]
Dans la première étude, les chercheurs ont disséqué, étape par étape, le processus d'assemblage d'un cluster [2Fe-2S] en utilisant un système reconstitué in vitro avec les protéines de la bactérie Escherichia coli et une combinaison de techniques biochimiques et spectroscopiques. Ils ont montré que l'assemblage est réalisé de manière séquentielle sur la protéine IscU, le fer venant se fixer en premier, puis le soufre sous forme d'un persulfure fourni par la cystéine désulfurase IscS. Des électrons sont alors fournis par une ferrédoxine (Fdx) pour cliver le persulfure en sulfure, ce qui conduit à la formation d'un précurseur [1Fe-1S] et par la suite à un cluster [2Fe-2S] par dimérisation d'IscU et fusion de deux précurseurs [1Fe-1S].
UNE RÉGULATION FINEMENT AJUSTÉE IMPLIQUANT LA FRATAXINE ET LA FERRÉDOXINE-2
Dans la seconde étude, l'équipe a mis au jour un jeu complexe de régulation de la synthèse des clusters [2Fe-2S] humains impliquant la ferrédoxine 2 (Fdx2) et la frataxine (Fxn). Le processus d'assemblage est similaire à celui observé dans le système bactérien : le fer se fixe à la plateforme d'assemblage Iscu2, puis le soufre sous la forme d'un persulfure fourni par la désulfurase Nfs1, persulfure qui est ensuite clivé en sulfure par Fdx2, générant ainsi un cluster [2Fe-2S]. La Fxn stimule l'ensemble du processus en accélérant le transfert du persulfure entre Nfs1 et Iscu2. À l'aide d'un système Isc humain reconstitué in vitro, les auteurs montrent que la réaction de synthèse est optimale quand les concentrations en Fxn et Fdx2 sont quasiment égales et que tout écart par rapport à cet équilibre diminue l'efficacité de la réaction. Ils montrent que ce phénomène est dû à une compétition entre Fxn et Fdx2 pour le même site de liaison sur le complexe entre Nfs1 et Iscu2.
Sur la base de leurs résultats in vitro, les chercheurs ont émis l'hypothèse que la diminution du taux de Fdx2 dans un contexte de déficit en Fxn (ataxie de Friedreich, FRDA), pourrait améliorer la biogenèse des clusters Fe-S in vivo. En utilisant la drosophile comme modèle de FRDA (baisse de Fxn), ils ont constaté que la diminution de l'expression de Fdx2 augmente la durée de vie des mouches, validant ainsi leur hypothèse.
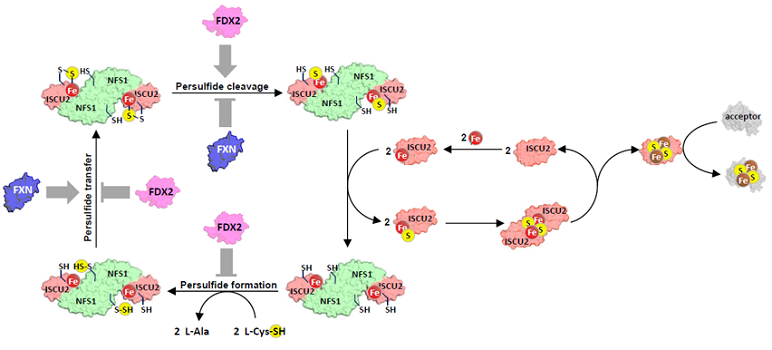
Régulation de la biosynthèse des clusters Fe-S via les effets antagonistes de la frataxine (Fxn) et de la ferrédoxine-2 (Fdx2)
© Want et al., 2025, Nature
En fournissant pour la première fois une description complète des étapes d'assemblage d'un cluster [2Fe-2S] in vitro, l'équipe a identifié des intermédiaires clés, tel que le précurseur [1Fe-1S] et a démontré l'existence d'une régulation croisée fine entre la Fxn et la Fdx2, qui explique la toxicité de la surexpression de la Fxn. Ceci devrait accélérer le développement de la thérapie génique pour FRDA. Ces résultats suggèrent également que, chez des patients FRDA, une diminution de l'expression de Fdx2 pourrait constituer une nouvelle voie thérapeutique.
Contact Joliot/I2BC : Benoît D'Autréaux (benoit.dautreaux@cea.fr ; benoit.dautreaux@i2bc.paris-saclay.fr)
- La
frataxine est une petite protéine de la matrice mitochondriale.
- Une équipe de la
Harvard Medical School a montré conjointement que, dans le ver modèle
C elegans, des mutations ponctuelles dans Fdx2 affectent son interaction avec Nfs1 et augmentent la survie des vers ne possédant pas de Fxn.
-
Laboratoires partenaires : Medical University of Gdansk, Poland ; Université de Strasbourg, CNRS,
IPHC UMR 7178 ;
ProFI, FR2048 CNRS CEA, Strasbourg ;
ICSN, CNRS, Université Paris-Saclay ; AMU, CNRS,
BIP, Marseille ; Université Paris-Cité,
BFA UMR8251.