La biologie structurale a eu un impact énorme sur la compréhension des processus cellulaires et aujourd'hui, la taille et la complexité des systèmes qui peuvent être étudiés ont très fortement augmenté. Paradoxalement, la plupart des connaissances proviennent d'études sur des systèmes isolés in vitro, hors du contexte cellulaire. En effet, dans leur grande majorité, les techniques de biologie structurale ne savent pas intégrer la complexité et le désordre du cytosol. La technique de PELDOR (Pulsed Electron DOuble Resonance) est un outil très puissant dans l'étude de la topologie et des changements structuraux des protéines et des acides nucléiques et l'une des rares techniques capable d'étudier la structure d'une protéine dans son environnement cellulaire. Par cette approche, on peut mesurer l'interaction magnétique entre deux centres paramagnétiques et en déduire des distances à l'échelle nanométrique. Les radicaux nitroxyde liés à des cystéines sont les sondes paramagnétiques les plus couramment utilisées, mais cette approche nécessite la purification et le marquage de la protéine in vitro. Afin d'obtenir des informations sur la structure de protéines dans leur environnement cellulaire natif, les auteurs ont suivi une stratégie très élégante qui utilise des complexes métal-peptide biosynthétiques comme marqueurs de spin de protéine permettant des mesures structurales non invasives dans la cellule intacte.
Ils ont construit une protéine artificielle formée de 3 hélices et comprenant, à chacune de ses extrémités, un Lanthanide Binding Tag (LBT), c'est-à-dire un peptide de 17 acides aminés à forte affinité pour le Gadolinium Gd(III), ion métallique paramagnétique, qu'ils ont exprimée chez E.coli (Fig.1). Lorsque l'on ajoute du Gd(III) dans le milieu de culture, les cellules assimilent cet ion métallique qui se lie au LBT formant ainsi une protéine doublement marquée. Les auteurs ont ensuite été capables de mesurer la distance intramoléculaire entre deux Gd(III) à partir de cellules intactes (Fig.1), distance en accord avec la structure prédite de la protéine artificielle.
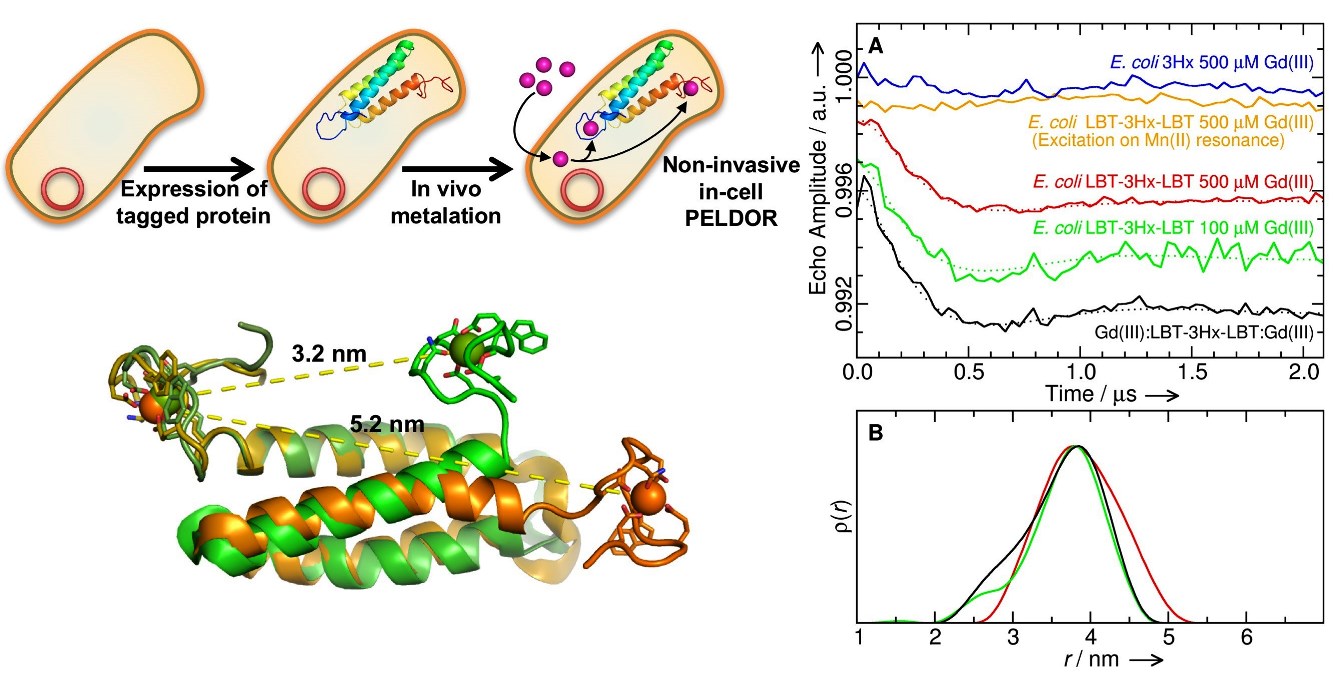
Figure 1 : La protéine artificielle à 3 hélices est exprimée avec un tag
LBT à chacune de ses extrémités dans E.coli.
Le Gadolinium ajouté au milieu de culture est transporté dans la cellule et
incorporé au LBT pour former le marqueur de spin (figure haut, gauche). La
structure du construit Gd(III):LBT-3Hélices-LBT:Gd(III) avec la plus longue et
la plus courte distance métal-métal calculée est représentée en bas à gauche de
la figure. A droite, sont montrés des enregistrements PELDOR représentatifs de
mesures in vitro et in vivo ; la distribution des
distances obtenues est également montrée.
Il s'agit de la première démonstration de l'utilisation d'une protéine biosynthétique porteuse d'un marqueur de spin produite pour des mesures PELDOR in vivo non invasives. La suite de ce travail sera d'appliquer cette méthode pour répondre à de vraies questions biologiques et de l'appliquer à différents types cellulaires. L'optimisation des mesures sera également menée, au niveau de l'échantillon lui-même et au niveau instrumental. Ce travail constitue une réelle avancée pour l'étude de la structure des protéines et des interactions protéine-protéine à l'intérieur des cellules. Cette méthode va sans doute devenir un outil important pour les recherches futures dans ces domaines.