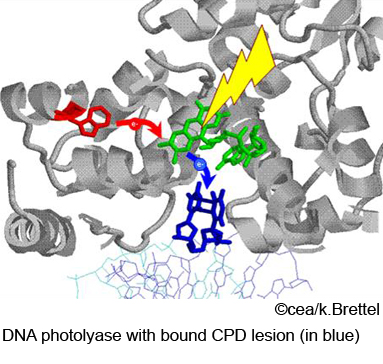
La principale lésion UV de l'ADN est le dimère de pyrimidines cyclobutane (CPD), dans lequel deux bases pyrimidiques adjacentes d'un même brin sont liées par deux liaisons covalentes (en bleu sur la figure). La photolyase reconnaît spécifiquement cette lésion et s'y lie; la réparation est alors initiée par l'absorption d'un photon bleu ou proche UV par l'enzyme, d'où son nom de photolyase. Elle est constituée d'un unique polypeptide de ~55 kDa et contient une flavine adénine dinucléotide (FAD; en vert) comme cofacteur principal; celle-ci doit être dans son état doublement réduit (FADH–) pour que l'enzyme puisse réparer l'ADN.
La réaction de réparation commence probablement par un transfert d'électron très rapide (subnanoseconde) de FADH– photoexcité vers le CPD. Les mécanismes détaillés de ce transfert d'électron et de la rupture du dimère sont cependant encore loin d'être bien établis.
Nous travaillons in vitro sur des photolyases isolées et des petits segments d'ADN contenant des CPD. La réparation est déclenchée par une impulsion laser courte et suivie en temps réel par des techniques d'absorption transitoire permettant d'identifier les intermédiaires de réaction; nous pouvons descendre jusqu'à une résolution temporelle de 500 ps dans notre laboratoire; pour les mesures à des échelles de temps plus rapides nous collaborons avec M. Vos à l' Ecole Polytechnique à Palaiseau.
La photolyase est le siège d'une deuxième réaction photoinduite, distincte de la réparation de l'ADN: la photoactivation. La photoactivation rétablit l'état doublement réduit et catalytiquement actif FADH– du cofacteur flavine à partir de l'état radicalaire semi-réduit FADH•. Ce dernier correspond à l'état stable dans la photolyase isolée mais ne permet pas la réparation de l'ADN. Le mécanisme de réaction suggéré met en jeu un transfert d'électron d'un résidu tryptophane exposé à la surface de la protéine (W306 dans la photolyase d’E. coli, en rouge) vers l'état excité de FADH•. Sur la base d'études par spectroscopie d'absorption transitoire, nous avons proposé (Aubert, C. et al, 2000) que deux autres résidus tryptophanes participent à la réaction en tant qu'intermédiaires redox, permettant un transfert d'électron ultrarapide, en trois étapes, sur une distance de ~15 Å. La déprotonation de W306•, que nous avons observée en ~200 ns, stabilise par la suite le radical sur ce résidu tryptophane.
Afin d'établir le rôle des deux résidus tryptophanes intermédiaires de la chaîne, nous combinons actuellement les techniques d'absorption transitoire et de mutagenèse dirigée (collaboration avec A. P. M. Eker de l'Université de Rotterdam). Les premiers résultats sont en accord avec le mécanisme de "hopping" proposé (Byrdin M. et al., 2003; Lukacs A. et al., 2006), mais les cinétiques de transfert d'électron entre les différents résidus tryptophanes restent à déterminer.
Ses caractéristiques uniques (structure résolue, chaîne de transfert d'électron composée d'acides aminés intrinsèques, réactions déclenchées par la lumière permettant des études à haute résolution temporelle, couplage entre transfert d'électron et transfert de proton) font de la photolyase un système paradigmatique pour l'étude des transferts intraprotéiques d'électrons et de radicaux d'acides aminés.
Les cryptochromes, photorécepteurs de lumière bleue chez les plantes et les animaux, sont des flavoprotéines ayant une forte homologie de séquence avec les photolyases, mais sans activité de réparation de l'ADN. En collaboration avec M. Ahmad (Université Paris 6), nous cherchons à identifier les réactions primaires suivant l'absorption de lumière bleue par les cryptochromes et à comprendre l'origine moléculaire de fonctions aussi différentes des cryptochromes et des photolyases. Nos premiers résultats sur un cryptochrome de plante (Giovani B. et al., 2003; Zeugner A. et al., 2005) ont mis en évidence un transfert d'électron photoinduit impliquant des résidus tryptophane et tyrosine.