LA DÉCOUVERTE des lymphocytes T rÉgulateurs
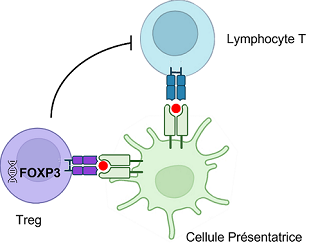
Les lymphocytes T sont les cellules de l'immunité qui orchestrent les réponses immunitaires, c'est-à-dire notre capacité à nous défendre envers des agents étrangers (i.e., le non-soi). Leur formation et leur sélection s'effectuent dans le thymus, un organe situé à la base du cou. Les lymphocytes T y sont sélectionnés vis-à-vis des molécules du soi, si bien que les lymphocytes T auto-réactifs reconnaissant ces molécules sont éliminés. Cette sélection est à l'origine de la tolérance centrale qui évite la mise en circulation de lymphocytes T auto-réactifs et donc d'une auto-immunité. Cependant, cette sélection n'est pas parfaite et certains lymphocytes T auto-réactifs échappent au tri du thymus et persistent dans l'organisme. Un second niveau de contrôle opère dans la circulation et les organes pour éviter les réactions auto-immunes : c'est la tolérance périphérique, c'est à dire un ensemble de mécanismes actifs qui empêche le déclenchement d'une réponse immunitaire contre les molécules du soi dans l'organisme. C'est dans ce domaine que les lauréats du Nobel 2025 ont apporté une contribution décisive en identifiant le gène FOXP3 et les lymphocytes T régulateurs (Treg) comme acteurs majeurs de la tolérance périphérique.
En 1995, Shimon Sakaguchi, immunologiste à l'Université d'Osaka, identifie une population rare de lymphocytes, les lymphocytes T régulateurs (Tregs) qui se révèlent capables de prévenir l'auto-immunité, jouant ainsi le rôle de frein actif complétant la sélection imparfaite des lymphocytes T dans le thymus. En 2001, Mary E. Brunkow et Fred Ramsdell, chercheurs à Seattle, découvrent qu'une mutation du gène FOXP3 provoque, chez un modèle murin, une inflammation systémique sévère. Peu après, des mutations analogues sont identifiées chez un enfant atteint du syndrome IPEX, une pathologie auto-immune généralisée. Le lien entre l'expression de FOXP3 et l'activité des Tregs sera fait en 2003 : l'expression de FOXP3 détermine la différenciation, la stabilité et la fonction suppressive des Tregs.
|
Le gène FOXP3 code pour un facteur de transcription essentiel au développement et au fonctionnement normal des lymphocytes T régulateurs (Tregs)
|
Les trois lauréats ont donc élucidé l'un des mécanismes fondamentaux de la tolérance immunitaire périphérique et la préservation du soi par des approches complémentaires, immunologique et génétique. Ils ont également ouvert la voie à de nouvelles stratégies thérapeutiques ciblant les Tregs.
LES APPLICATIONS POTENTIELLES
Les Tregs constituant un pivot de la tolérance périphérique, leur activation pourrait servir à freiner les réactions auto-immunes et inflammatoires. De nombreux essais cliniques visant à renforcer ou à transférer des Tregs afin de restaurer une tolérance chez des patients atteints de maladies auto-immunes ou allergiques, ou encore de réduire le risque de rejet de greffe, sont en cours actuellement. À l'inverse, des approches visant à faire taire les Tregs infiltrant les tumeurs afin qu'elles ne bloquent pas l'action des cellules immunitaires chargées de détruire les cellules cancéreuses, sont prometteuses pour renforcer l'immunité antitumorale.
DÉCRYPTAGE FLASH

Voir également le décryptage de Bernard Maillère dans une courte vidéo
réalisée avec la cellule communication de la DRF.
Les T regs à Joliot : rôle dans la réponse au FVIII de coagulation humain recombinant chez des patients hémophiles.
Un axe de recherche développé au sein de l'équipe de Bernard Maillère (SIMoS/DMTS) est la compréhension des mécanismes d'immunogénicité (déclenchement d'une réponse immunitaire) et de tolérance aux biomédicaments permettant de réduire les réponses immunitaires non désirées contre les molécules thérapeutiques d'origine biologique (anticorps, protéines, vecteurs viraux). Ainsi, les chercheurs étudient depuis plusieurs années la réponse immunitaire cellulaire au facteur de coagulation FVIII, une protéine essentielle à la coagulation sanguine et dont le déficit congénital est responsable de l'hémophilie A (HA). Or, environ 30% des patients HA traités par le FVIII humain recombinant développent des anticorps neutralisant la protéine thérapeutique. Dans une étude récente, les chercheurs ont mis en évidence pour la première fois la présence de lymphocytes Tregs spécifiques du FVIII humain dans le sang de donneurs sains, mettant en lumière l'existence d'un mécanisme de tolérance au FVIII chez ces donneurs. Des études supplémentaires devraient permettre de clarifier les mécanismes de tolérance périphérique au FVIII et le rôle des Tregs dans la réduction de l'immunogénicité du FVIII recombinant (voir actu Joliot).