Nous manquons cruellement de ressources thérapeutiques contre de nombreux virus et bactéries toxiques, sources d'épidémies naturelles (virus Ebola, colibacilles producteurs de toxines de Shiga…) ou constituant un risque d'attaques bioterroristes.
Le CEA/Joliot et l'Institut Curie travaillent depuis plusieurs années à la mise au point d'un principe thérapeutique révolutionnaire. Plutôt que de s'attaquer directement aux pathogènes, les scientifiques des deux organismes cherchent à comprendre le mécanisme cellulaire dont dépendent de nombreux virus et toxines pour exercer leurs effets délétères. Ainsi, une unique molécule pourrait être efficace contre de très nombreux pathogènes. Ils ont mis au point et synthétisé, il y a quelques années, des composés nommés Retro-2 (brevet CEA – Institut Curie, Stechmann
et al, 2010), capables de bloquer l'action néfaste de plusieurs virus et toxines.
Ils ont ainsi démontré l'efficacité
in vitro des molécules de la famille Retro-2 contre pas moins de 3 toxines, 12 virus, 3 bactéries intracellulaires et 2 parasites, (Gupta
et al, 2017). Une preuve d'efficacité a été montrée
in vivo chez la souris contre la ricine, le colibacille O104:H4 (voir encadré), le virus de la vaccine (modèle de la variole), l'entérovirus 71 (un virus provoquant de graves lésions cérébrales chez l'enfant), le cytomégalovirus (provocant des infections chez les personnes immunodéprimées) et deux espèces du parasite de la leishmaniose.
Cependant, le mécanisme cellulaire précis de cette action protectrice de Retro-2 n'était toujours pas élucidé. Dans cette étude publiée dans
NatureChemical Biology, les chercheurs du CEA et de l'Institut Curie, en collaboration avec l'Institut Carnegie Mellon aux Etats-Unis, ont utilisé la toxine de Shiga comme toxine bactérienne modèle et montré que les molécules de la famille Retro-2 sont capables de bloquer la circulation dans la cellule de la protéine syntaxine-5 (Stechmann
et al, 2010), protéine indispensable à la progression de plusieurs virus et toxines. Cependant, ces molécules n'agissent pas directement sur celle-ci mais sur une protéine nommée Sec16A, véritable cible intracellulaire des molécules Retro-2. En effet, c'est en se fixant à la protéine cellulaire Sec16A, qui elle-même contrôle la circulation de la syntaxine-5 dans la cellule, que les molécules de la famille Retro-2 exercent leur effet antiinfectieux (voir schéma).
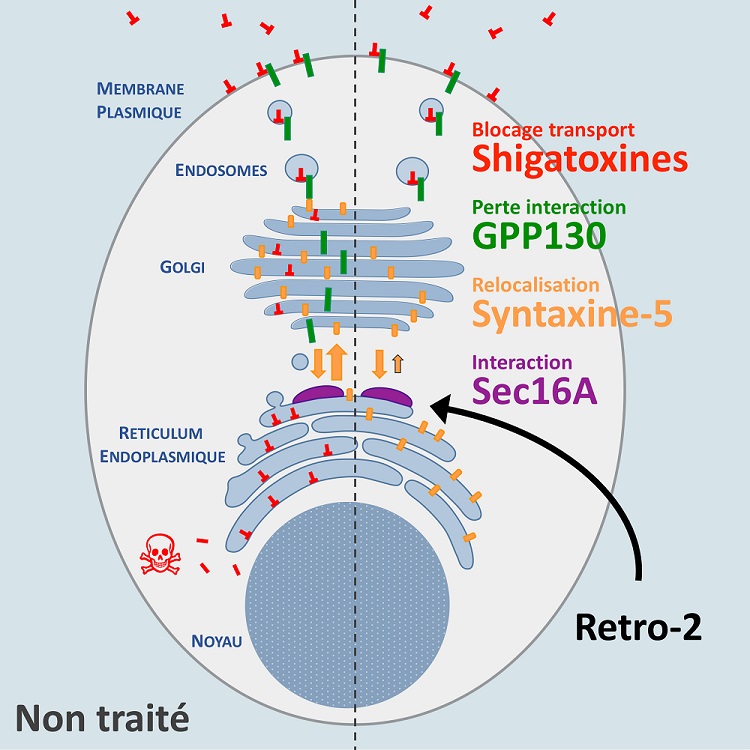
L'identification de la cible intracellulaire de Retro-2 constitue une étape nécessaire dans la mise au point d'une nouvelle thérapie. Les chercheurs de Joliot peuvent dès lors entamer un programme de développement destiné à conduire cette nouvelle entité chimique jusqu'à la clinique.
Ce travail a fait l’objet d’un communiqué de presse commun du CEA et de l’institut Curie le 18 février 2020, dont est tirée la présente actualité.
Lien vers le communiqué
Pour en savoir plus
 Structure de Retro-2
Structure de Retro-2
Retro-2, issu d'un crible chimique mis au point au SCBM dans le cadre de la lutte contre le bioterrorisme, est capable d'agir sur le mécanisme de progression dans les cellules de nombreux agents pathogènes.
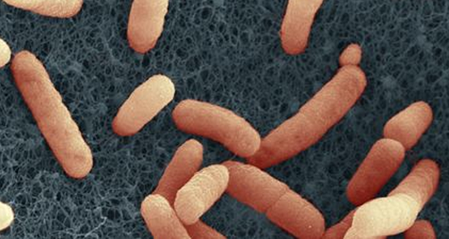 A propos du colibacille
Escherichia coli (E. coli) O104:H4E.coli est une bactérie qui s'établit dans le tube digestif de l'homme et des animaux à sang chaud. La majorité des souches d'E.coli sont inoffensives, quelques-unes seulement sont pathogènes (entérohémorragiques). C'est le cas de la souche O104:H4 qui produit la toxine de Shiga, qui fut à l'origine de l'épidémie liée à la consommation de graines de fenugrec germées en 2011 en Allemagne et en Europe. Photo du Robert Koch Institüt, Allemagne
A propos du colibacille
Escherichia coli (E. coli) O104:H4E.coli est une bactérie qui s'établit dans le tube digestif de l'homme et des animaux à sang chaud. La majorité des souches d'E.coli sont inoffensives, quelques-unes seulement sont pathogènes (entérohémorragiques). C'est le cas de la souche O104:H4 qui produit la toxine de Shiga, qui fut à l'origine de l'épidémie liée à la consommation de graines de fenugrec germées en 2011 en Allemagne et en Europe. Photo du Robert Koch Institüt, Allemagne