Les astrocytes, longtemps considérées comme de « simples » cellules de soutien des neurones, jouent un rôle important dans diverses fonctions cérébrales. Ils contribuent à rendre la barrière sang-cerveau (barrière hémato-encéphalique- BHE) « étanche », protégeant le tissu cérébral (et les neurones) des molécules indésirables (toxiques) présentes dans le sang, en ne laissant entrer que celles qui lui sont nécessaires. Ils interviennent, entre autres, dans le couplage neurovasculaire, c’est-à-dire l’augmentation locale du flux sanguin (et du métabolisme énergétique) dans les régions qui s’activent. Ils joueraient aussi un rôle déterminant dans le système « glymphatique » (encore hypothétique), qui servirait à éliminer les « déchets » qui se forment dans le cerveau en favorisant la circulation du liquide cérébro-spinal et du liquide interstitiel. Son dysfonctionnement pourrait être responsable de l’apparition de certaines maladies neurodégénératives (comme la maladie d’Alzheimer) du fait de l’accumulation d’agrégats dans le cerveau. Ces fonctions sont en partie liées à la possibilité pour les astrocytes de réguler les flux d’eau entre sang et cerveau grâce à la présence dans leur membrane de canaux spécifiques à l’eau, les aquaporines de type 4 (1 des 12 types existant dans le corps), qui contrôlent les entrées et les sorties des molécules d’eau. Ainsi, les astrocytes se gonflent ou se rétractent selon les besoins. Dans le cerveau seuls les astrocytes expriment les aquaporines (et pas les neurones).
De façon remarquable, les propriétés et fonctions des astrocytes, qui sont six à huit fois plus nombreux que les neurones ont une importance technique majeure pour l’imagerie du cerveau. L’IRM de diffusion (IRMd, technique développée par Denis Le Bihan dans les années 1980) explore les micromouvements des molécules d’eau (plus ou moins contraints en fonction de l’environnement local). Elle est largement utilisée pour le diagnostic d’AVC ischémique à la phase aigüe, la reconstitution du trajet de fibres nerveuses (tractographie, la diffusion de l’eau dans les axones étant anisotrope et orientée dans le sens des fibres) et pour les diagnostics des cancers (sein, prostate, etc.). Ces succès sont liés à la très grande sensibilité de l’IRMd aux modifications de la microstructure des tissus, comme le gonflement des cellules, astrocytes ou neurones par exemple. Elle pourrait donc être utilisée pour étudier les astrocytes et tester leur implication dans le système glymphatique chez l’Homme, et remplacer avantageusement les méthodes actuelles invasives qui consistent à injecter dans le cerveau d’animaux un agent de contraste IRM (chélate de gadolinium) pour suivre sa migration. Mais l’IRMd permet aussi de détecter et localiser l’activation neuronale (IRMfd), une alternative à l’IRM fonctionnelle par effet « BOLD » (IRMf BOLD), très utilisée en neurosciences cognitives. La méthode BOLD repose sur l’équilibre entre les formes oxy- et déoxy- de l’hémoglobine des globules rouges circulant. Du fait du couplage neurovasculaire (auquel les astrocytes contribuent donc fortement) l’activation neuronale s’accompagne d’une augmentation locale du débit sanguin, et de l’équilibre oxy/deoxyhémoglobine du sang en faveur de la forme « oxy ». Le petit changement d’aimantation qui en résulte permet d’obtenir des cartes de l’activité cérébrales. Reposant sur ce couplage neurovasculaire, l’IRMf BOLD est de fait un détecteur indirect de l’activité neuronale qui est parfois mis en défaut et qui souffre d’une résolution spatiale et temporelle limitée (la réponse vasculaire est décalée de plusieurs secondes par rapport à la réponse neuronale, ce qui est bien-sûr considérable). L’IRMf par IRMd (développée par Denis Le Bihan dans les années 2000 avec des collègues japonais de l’université de Kyoto) ne souffre pas de ces inconvénients car elle repose a priori sur un principe totalement différent et plus direct : le gonflement des neurones (ou plus précisément de parties des neurones comme les épines dendritiques), ce que Denis Le Bihan a dénommé couplage « neuromécanique ». Ce mécanisme est, toutefois, encore hypothétique, même si les équipes de Denis Le Bihan et d’autres dans le monde ont publié ces dernières années une série d’articles allant dans ce sens.
Dans deux études publiées dans PLoS ONE, les chercheurs de NeuroSpin ont bloqué l’activité astrocytaire en utilisant le TGN-020, un inhibiteur des canaux aquaporine 4, dans un modèle murin, et regardé l’impact de ce blocage sur les images de diffusion, tant dans le cadre de l’IRMfd que dans celui du système glymphatique.
Dans la première étude[1], au repos, l’administration de TGN-020 se traduit par une petite augmentation du coefficient de diffusion de l’eau dans le tissu cérébral et une diminution du Sindex, un marqueur plus sensible de la microstructure tissulaire, d’autant plus que les régions sont riches en astrocytes (cortex, hippocampe). Cette augmentation s’expliquerait par le blocage du gonflement astrocytaire et l’augmentation de l’espace interstitiel qui en résulte. L’IRMd (et son Sindex) semble donc constituer un bon candidat pour étudier le la contribution des astrocytes au système glymphatique de manière totalement non invasive, éventuellement chez l’homme.
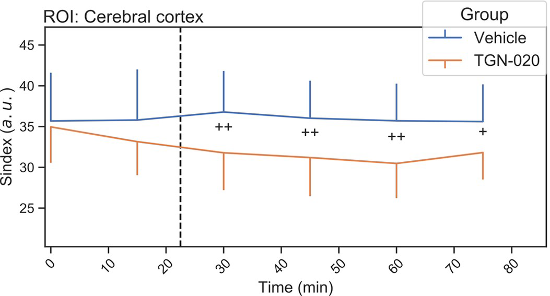
Exemple d'évolution au cours du temps du S-index dans le cortex cérébral. La ligne bleue correspond au groupe contrôle et la ligne orange au groupe TGN-020. La barre d'erreur indique l'écart-type. La ligne pointillée représente le temps d'injection. © Debaker C. et al., PLoS ONE, 2020.
Dans la deuxième étude[2], lors d’une activation neuronale (stimulation visuelle), les auteurs ont comparé les signaux obtenus par IRMf BOLD et IRMf de diffusion. La réponse observée par IRMf BOLD est altérée sous TGN-020, ce qui confirme le rôle des astrocytes dans le couplage neurovasculaire à l’origine des signaux d’IRMf BOLD. Elle confirme aussi une des limites de cette méthode d’IRMf puisqu’en fait la réponse neuronale reste inchangée sous TGN-020, ce dont attestent les mesures électrophysiologiques. La réponse observée par IRMf par diffusion est au contraire non altérée sous TGN-020, comme cela doit l’être. Ces résultats confirment l’indépendance de l’IRMfd du couplage neurovasculaire et des astrocytes, et donc son origine directement neuronale. Le « gonflement neuronal », au niveau des milliers d’épines dendritiques présentes pour chaque neurone, reste possible car justement les neurones ne disposent pas, à la différence des astrocytes, d’aquaporines pour réguler les flux d’eau, ce qui suggère fortement que ce gonflement est nécessaire au fonctionnement du neurone.
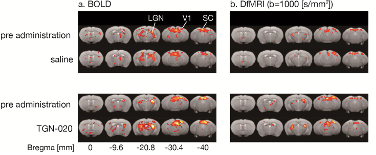
Cartes d'activation (a : BOLD, b : IRMfD b1000 - Comparaison des cartes d'activation avant et après l'administration de TGN-020 (panneaux du bas) ou de solution saline (panneaux du haut). © Komaki Y. et al., PLoS ONE, 2020.
Contact :
Denis Le Bihan