La quête de catalyseurs efficaces et résistants à l’oxygène a conduit les chercheurs à étudier certaines enzymes douées de pouvoirs catalytiques performants. Il s’agit des hydrogénases, que l’on retrouve par exemple dans des bactéries ou des micro-algues. D’une façon générale, l’activité de ces enzymes dépend, notamment, d’échanges d’électrons entre leur surface et leur centre catalytique ou partie fonctionnelle. Toutefois, le panel des hydrogénases est large, leur fonctionnement pluriel. Par exemple, des analyses biochimiques ou de cristallisation ont révélé que certaines de ces enzymes comportent des colliers d’agrégats métalliques entre leur surface et leur centre catalytique qui permettent le passage des électrons. D’autres n’en sont sont pas dotées et le transfert des électrons s’effectue directement.
Des chercheurs du CEA-IBITECS, à Saclay, du CNRS, à Marseille et de l’Université de Toulouse ont mis au point une méthode simple et rapide pour déterminer le type de transfert électronique entre la surface des hydrogénases et leur centre catalytique. Cette technique d’électrochimie consiste à appliquer une tension variable (V) dans une solution contenant ces enzymes et à mesurer l’intensité (I), directement liée aux mouvements des électrons et à la catalyse. Les courbes résultats (V en fonction de I et leurs dérivées), appelées voltamogrammes, affichent des formes caractéristiques, des vagues catalytiques que l’on peut directement associer à la nature du transfert électronique. Cette technique a été validée sur les hydrogénases de l’algue verte Chlamydomonas reinhardtii et de la bactérie Clostridium acetobutylicum.
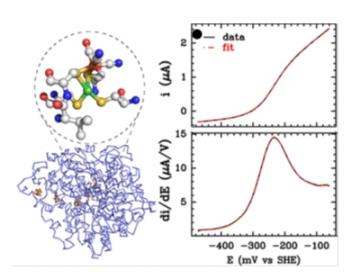
à gauche, structure de l’hydrogénase de Clostridium acetobutylicum avec un zoom sur son centre catalytique ; à droite, un voltamogramme de l’hydrogénase. (© CEA)