Comment les cellules vivantes se divisent-elles, sécrètent des hormones ou se transmettent des signaux ? Pour le comprendre, les biologistes fixent des sources de lumière de couleurs variées à des protéines, afin de suivre au microscope leurs mouvements et interactions dans les cellules. Et plus il y a de couleurs disponibles, plus il est possible de suivre de processus différents en même temps.
Ces marqueurs ont été mis au point dans les années 1990, à partir d'une protéine émettant dans le vert provenant d'une méduse bioluminescente. Puis, d'autres couleurs ont vu le jour, grâce à des travaux impliquant notamment le CEA-Irig, jusqu'à découvrir dans les coraux une protéine fluorescente rouge. Encore fallait-il pouvoir l'optimiser pour la recherche. C'est à cette tâche que se sont attelés des spécialistes néerlandais de biologie cellulaire, faisant notamment appel à l'expertise en biologie structurale de l'Irig. En 2016, ils mettaient au point la protéine mScarlet.
De l'importance d'un repliement rapide
Rapidement utilisée en biologie cellulaire dans de nombreux laboratoires à travers le monde, elle s'est avérée toutefois moins performante dans les cellules de mammifères que les protéines vertes. En cause, la lenteur et l'efficacité relative de son repliement. « La qualité du repliement de la protéine est très importante car c'est lors de ce phénomène que le chromophore fluorescent se crée, par cyclisation oxydative de trois acides aminés consécutifs. Par ailleurs, l'environnement du chromophore doit être très rigide pour qu'il puisse fluorescer de façon efficace », détaille Antoine Royant, biocristallographe à l'Irig.
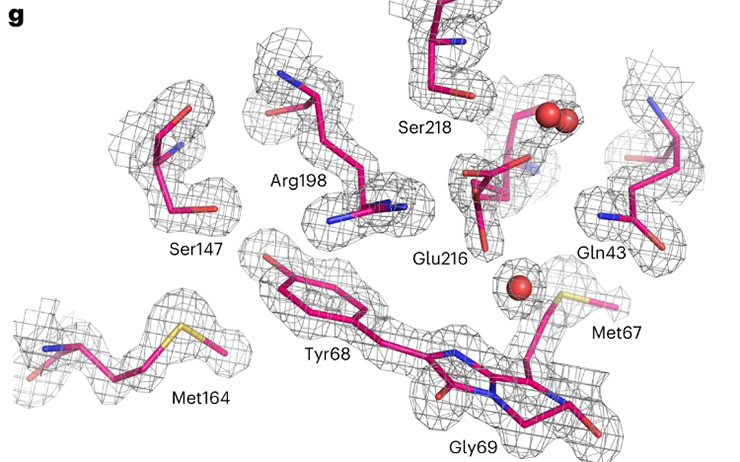
La collaboration a donc cherché à accélérer et maximiser ce repliement, en apportant des modifications ciblées de la structure de deux variants de mScarlet. Elle présente aujourd'hui mScarlet3, aux performances remarquables et dont la structure a été observée par l'équipe du chercheur au synchrotron ESRF. « Nous avons découvert dans la protéine la présence d'un élément de structure hydrophobe. Il pourrait expliquer le repliement rapide de mScarlet3, grâce à la stabilité de l'environnement qu'il confère », suppose l'expert qui a déjà cartographié de nombreuses structures de protéines fluorescentes.
Avec cette version nettement améliorée de protéine fluorescente rouge, la boîte à outils des scientifiques est désormais plus complète que jamais. D'autant qu'elle est très recherchée, car son excitation est moins nocive pour les cellules que celle d'une protéine verte et elle peut être effectuée dans des tissus plus en profondeur. « Les expériences avec mScarlet étaient déjà très satisfaisantes, c'est pourquoi nous nous attendons à ce que mScarlet3 devienne encore plus populaire parmi les chercheurs et s'impose comme le nouveau standard dans le monde », conclut Dorus Gadella, biologiste à l'université d'Amsterdam.