Ces chercheurs ont montré que des molécules motrices, les
myosines, étaient responsables de la contraction sélective de certaines
structures intracellulaires formées par l’actine, protéine abondamment
présente dans les cellules. Le mécanisme mis en lumière permet de
comprendre comment la génération de forces à l’intérieur des cellules
peut être modulée localement et de façon très précise. De tels résultats
ouvrent de nouvelles perspectives, en particulier pour la compréhension
de dysfonctionnements observés dans certaines pathologies graves comme
le cancer.
Ces travaux sont publiés en ligne, le 07 juin, par la revue Science.
Les
cellules sont dotées d’un « squelette » de nature protéique (le
cytosquelette) qui est à l’origine de forces leur permettant notamment
de changer de forme pour se déplacer ou se diviser. Le cytosquelette est
formé de trois fibres principales : les microtubules, les filaments
intermédiaires, et les microfilaments ou filaments d’actine. Dans cette
étude, les chercheurs se sont intéressés aux filaments d’actine connus
pour être un acteur moléculaire essentiel pour la production de force de
contraction au sein des cellules.
Un filament d’actine est un
polymère[3] polarisé (ou orienté) pouvant s’organiser en différentes
architectures : soit parallèles (tous les filaments sont dans le même
sens), soit anti-parallèles (en sens opposés) ou en réseaux denses
(entrecroisés). A l’image de ce qui se passe pour les muscles de
l’organisme, il existe, au niveau du cytosquelette de chaque cellule,
des contractions très localisées. A l’origine de ces contractions, les
myosines : des protéines motrices qui déplacent et déforment les
filaments d’actine. Au sein d’une cellule, les différentes architectures
d’actine sont agencées de telle sorte qu’il s’avère extrêmement
complexe de les étudier séparément. C’est pour cette raison que, jusqu’à
présent, il n’était pas possible d’étudier l’impact qu’a l’agencement
des filaments d’actine sur la force exercée par les myosines.
Dans
le cadre de cette étude, les chercheurs ont créé un dispositif imitant
un squelette cellulaire dans lequel les différentes architectures de
filaments d’actine sont géométriquement séparées les unes des autres,
devenant ainsi aisément identifiables. Les analyses réalisées grâce à ce
dispositif ont montré que les molécules de myosine agissent de façon
spécifique et sélective sur le cytosquelette au cours de la contraction.
Ainsi, sous l’action des myosines, les filaments antiparallèles
d’actine se contractent rapidement, tandis que les filaments agencés en
réseaux se contractent plus lentement ; quant aux filaments parallèles,
ils ne se contractent pas du tout. Ces phénomènes sélectifs suggèrent
que, dans l’espace intracellulaire, l’action des myosines n’induit la
contraction que de certaines structures ciblées. Les résultats obtenus
indiquent également que, dans la cellule, la vitesse de contraction et
la déformabilité de chaque filament d’actine sont déterminées par son
agencement.
[1] Squelette des cellules, composé notamment de filaments d’actine, qui remplit diverses fonctions de soutien et de transport.
[2] Laboratoire de physiologie cellulaire et végétale (CEA/CNRS/INRA/Université Joseph Fourier Grenoble).
[3] Molécule de grande taille, caractérisée par la répétition d’un même motif.
Outre l’importance de ces résultats pour la
connaissance fondamentale des mécanismes qui régissent certaines
propriétés essentielles des cellules, cette étude constitue une première
étape dans le cadre de travaux qui permettraient de déterminer
l’origine des dysfonctionnements mécaniques intracellulaires retrouvés
dans des pathologies aussi graves que le cancer.
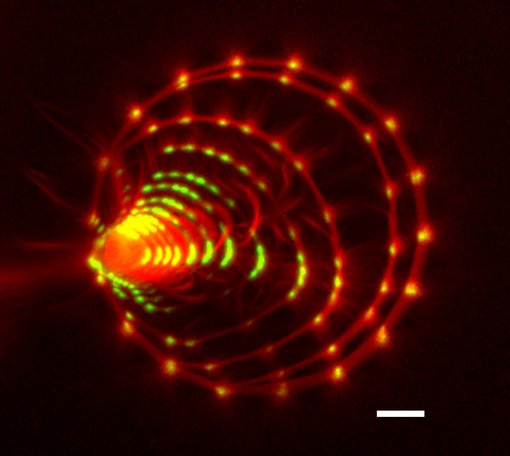
Superposition d’images prises au cours du temps illustrant la
déformation d’un anneau de filaments d’actine (en rouge) sous l’action
des myosines (en vert) dans une structure biomimétique. A partir de
l’analyse de la vitesse de constriction de l’anneau, il est possible de
déterminer la propriété contractile de ce type de structure. Echelle : 5
micromètre. © Anne-Cécile Reymann