Les chaperons d'histones aident à l'assemblage et au désassemblage des histones autour desquels s'enroule l'ADN de nos chromosomes.
Depuis 20 ans, les chercheurs de l'I2BC au CEA-Joliot étudient le chaperon d'histone ASF1 dont la concentration au sein des cellules augmente très fortement dans certaines tumeurs. À l'inverse, la diminution de sa concentration ralentit fortement la prolifération cellulaire.
ASF1 est donc une cible thérapeutique dans la lutte contre certains cancers, en particulier les cancers du sein très agressifs. Pour bloquer l'action de cette protéine chaperon, les chercheurs du CEA-Joliot développent une stratégie basée sur la conception de peptides, molécules formées de courtes chaînes d'acides aminés, qui s'associent à ASF1 à la place des histones et inhibent ainsi l'action de la protéine chaperon.
Dans une étude mêlant approches structurales, informatiques et biochimiques, l'équipe avait créé des peptides qui ont montré un effet inhibiteur potentiel sur la croissance tumorale. Ces premiers peptides étudiés étaient trop fragiles pour être utilisés en thérapie.
Les chercheurs ont alors entrepris de produire de nouveaux composés à partir de briques de synthèse afin de les rendre plus résistants sans modifier leur activité thérapeutique. Ils se sont servi pour cela de polymères artificiels, les foldamères, capables de former des structures bien définies, de façon analogue aux molécules du vivant.
Les travaux de modélisation ont permis la conception d'un nouvel inhibiteur d'ASF1 sous la forme d'une molécule hybride de foldamère et de peptide. Sa résistance à la dégradation dans le plasma humain est bien supérieure à celle du peptide apparenté. De plus, sa structure révèle une plasticité remarquable qui s'adapte à la surface d'ASF1 et maintient la même interface de liaison que le peptide inhibiteur précédemment conçu.
Il reste encore à optimiser cette molécule hybride pour lui permettre d'atteindre la protéine chaperon ASF1 au sein de la cellule afin d'inhiber efficacement son action .
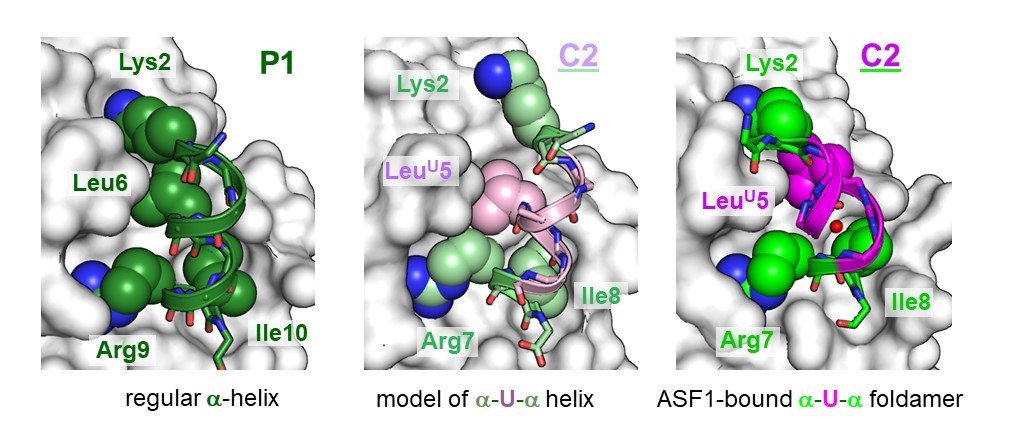 Comparaison de la structure du peptide hybride (C2) seul (milieu) ou en interaction avec ASF1 (droite) avec celle du peptide P1 lié à ASF1 (gauche). P1 correspond à la partie hélicoïdale du peptide ip4 trouvé dans la précédente étude. © F. Ochsenbein / CEA .
Comparaison de la structure du peptide hybride (C2) seul (milieu) ou en interaction avec ASF1 (droite) avec celle du peptide P1 lié à ASF1 (gauche). P1 correspond à la partie hélicoïdale du peptide ip4 trouvé dans la précédente étude. © F. Ochsenbein / CEA .